Vamos a ir al laboratorio para analizar el calor producido por varios alimentos. Quemaremos varios alimentos y aprovecharemos el calor que desprenden para calentar agua, medir la diferencia de temperatura del agua en su estado inicial y en su estado final, y de esta forma, calcular su valor calórico.
El valor calórico (Q) se mide indirectamente con la fórmula:
Q = m(agua) c (tf-ti)
- m= masa de agua. Para calcularla hay que saber su densidad= 1g/cm3
- c= calor específico del agua = 1 cal/(g·°C)
- tf y ti= temperaturas final e inicial del agua en ºC
Trabajaremos en grupos, cada grupo con una muestra de alimento. Al finalizar, pondremos los resultados en común y completaremos la tabla. Cada grupo hará un informe final con:
- La hipótesis formulada: ¿Qué alimento es más calórico?
- Descripción del experimento (materiales, procedimiento, variables independiente y dependiente)
- Datos recogidos en la tabla
- Conclusiones
Concluiremos con un debate en el grupo de clase.
¿Qué necesitamos?
Materiales y productos:
¿Cómo lo hacemos?
Antes de realizar el experimento formulamos nuestra hipótesis:
Procedimiento:
- Hacemos el montaje de la fotografía (imagen: sciende photo library) y vamos anotando los datos en la tabla.
- Pesamos una pequeña cantidad del alimento que vayamos a quemar (frutos secos: pistachos, nueces, cacahuetes...).
- Colocamos el alimento en una aguja enmangada y lo sujetamos mediante la pinza en el soporte.
- Ponemos una cantidad de agua en el tubo de ensayo y medimos su temperatura con un termómetro que introduciremos en su interior.
- Quemamos el trocito de alimento con un mechero y lo dejamos arder hasta que se apague la llama.
- Anotamos el aumento de temperatura que ha sufrido el agua.
- Esperamos a que se enfríen los restos de alimento y volvemos a pesarlo.
- Aplicamos la fórmula para transformar la variación de temperatura en calorías
Recogiendo datos
Cada grupo expone los resultados obtenidos y, entre todos, completamos la tabla:
|
Muestras
|
Masa inicial de alimento (g)
|
Masa de agua (g)
|
Temperatura inicial del agua (ºC)
|
Temperatura final del agua(ºC)
|
Masa final de alimento (g)
|
Calorías
|
| Muestra 1 |
|
|
|
|
|
|
| Muestra 2 |
|
|
|
|
|
|
| Muestra 3 |
|
|
|
|
|
|
| Muestra 4 |
|
|
|
|
|
|
- Recordamos para calcular el valor calórico: Q = m(agua) c (tf-ti),
- Realizamos nuestro informe.
- Comparamos los datos con las tablas calóricas y obtenemos conclusiones.
Conclusiones y debate
En grupo establecemos nuestras conclusiones, comparando los valores obtenidos con nuestras hipótesis, con los valores que aparecen en las tablas y con las dificultades encontradas:
*Recordamos que para comparar las calorías calculadas con las que aparecen en las tablas (por 100g de alimento) hay que referirlas a la misma cantidad de alimento.
Realizamos el debate, para ello tenemos en cuenta las siguientes cuestiones:
- ¿Se ha cumplido nuestra hipótesis?
- Los resultados de nuestro experimento, ¿son similares a los valores de las tablas calórica?
- En caso de que no sean similares ¿Por qué puede ser?
- ¿Podemos hacer un “ranking” calórico con los alimentos experimentados?
- ¿Qué dificultades hemos tenido?



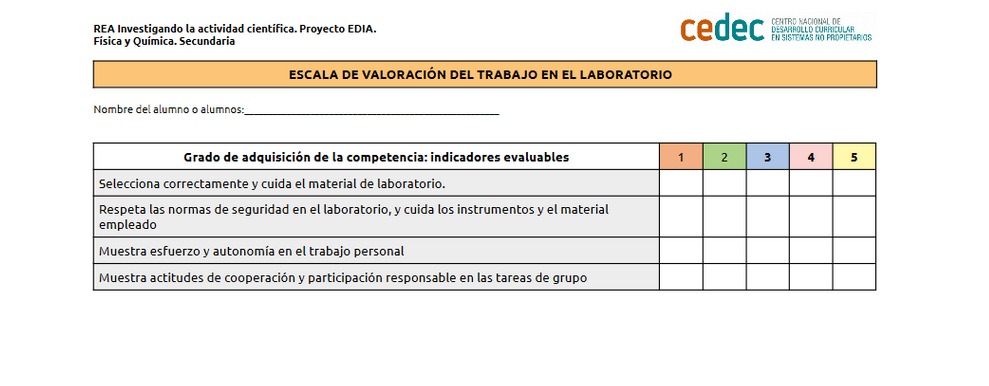
.png)
.png)