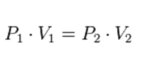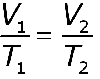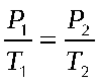Según la teoría cinética, las partículas en estado gaseoso se mueven con total libertad y tiende a expandirse, por lo que es difícil medir la cantidad de un gas. Para solucionar este problema los científicos recurren a tres variables macroscópicas (volumen, temperatura y presión) que se pueden relacionar con variables microscópicas ( el número de choques de las partículas y la velocidad de estas). Veamos estos conceptos:
Volumen. Es el espacio que ocupan las partículas del gas. Como el gas tiende a expandirse, el volumen será el mismo del recipiente. En el sistema internacional se mide en metros cúbicos(m³) pero la unidad más utilizada es el litro.
1 metro cúbico= 1000 litros
1 litro = 1 centímetro cúbico
Temperatura. Según la teoría cinética, la temperatura mide la velocidad de las partículas del gas. Normalmente utilizamos la escala centígrada (ºC) para medirla, pero en el sistema internacional se utiliza la escala Kelvin (K).
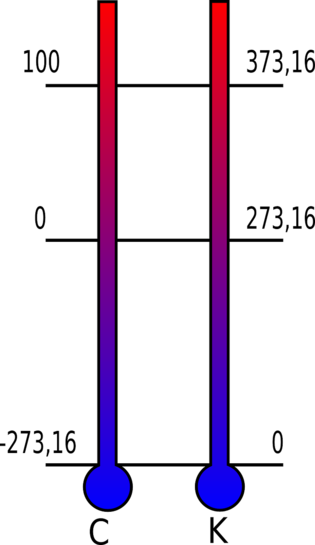 Termómetro Celsius-Kelvin. Pixabay
Termómetro Celsius-Kelvin. Pixabay
T (K) = T(ºC) +273
Presión. Según la teoría cinética indica el número de choques por unidad de tiempo de las partículas del gas con las paredes del recipiente.
En el sistema internacional la presión se mide en en Pascales´(Pa), aunque es muy común utilizar como unidades la atmósfera (atm) y los milímetros de mercurio (mmHg).
1 atm= 760 mmHg= 101300 Pa
Los científicos para estudiar los gases se centraron en estas tres magnitudes, dejaron una fija y vieron como se relacionaban las otras dos. Esta investigación por parte de los científicos dio lugar a las leyes de los gases:
Ley de Boyle- Mariotte
Robert Boyle y Edme Mariotte llegaron a la misma conclusión al estudiar la relación entre la presión y el volumen dejando fija la temperatura, dando lugar a la ley que lleva el nombre de ambos científicos.
Esta ley establece que cuando un gas sufre una transformación a temperatura constante, la presión del gas es inversamente proporcional al volumen del gas.
La siguiente animación nos muestra cómo al aumentar la presión sobre el gas el volumen disminuye.
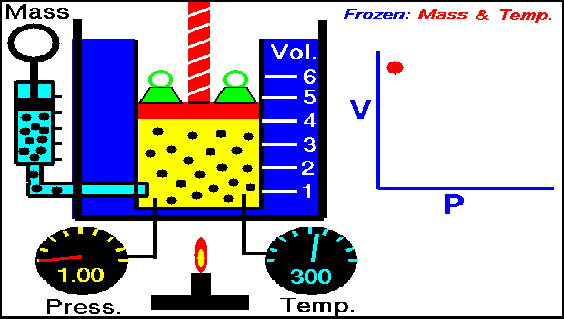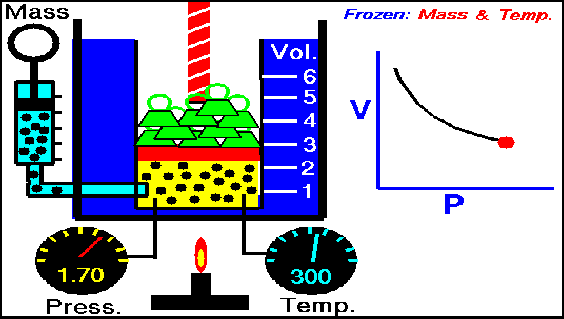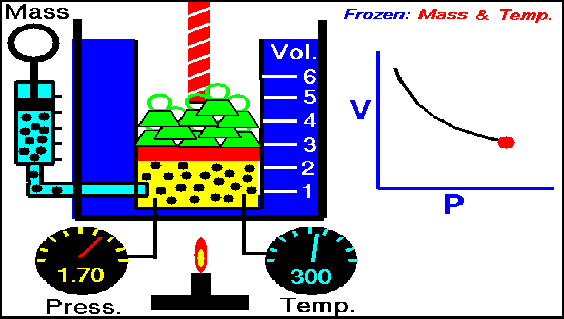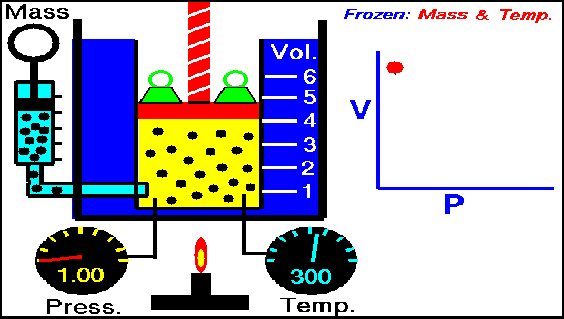 Gif ley de Boyle- Mariotte. Wikipedia
Gif ley de Boyle- Mariotte. Wikipedia
Matemáticamente la Ley de Boyle y Mariotte queda recogida en la siguiente expresión:
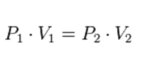
Donde la presión se expresa en atmósfera y el volumen en litros,
Si queremos ampliar nuestros conocimientos sobre esta ley podemos visitar los siguientes enlaces:
Ley de Charles
El científico francés Jacques Alexandre Charles estudió el comportamiento de los gases cuando se mantenía constante la presión y llegó a la conclusión que al aumentar la temperatura aumenta el volumen.
Esta ley establece que cuando un gas sufre una transformación a presión constante, la temperatura del gas es directamente proporcional al volumen.
La siguiente animación nos muestra como al aumentar la temperatura aumenta el volumen.
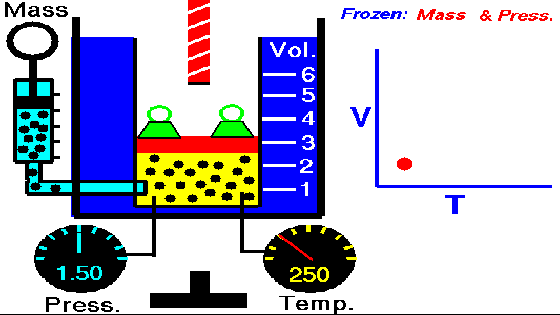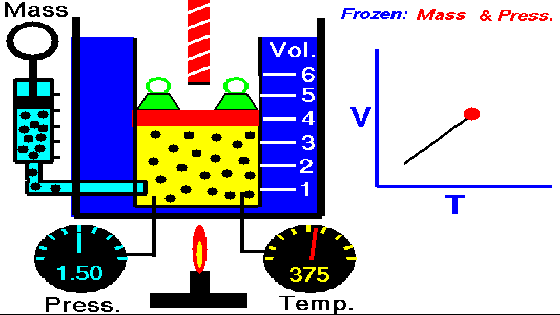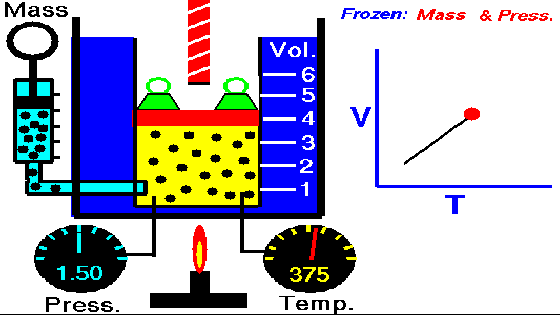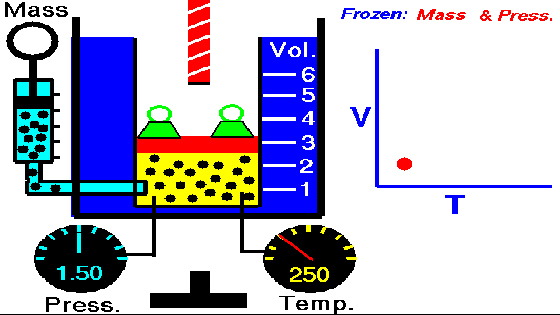 Gif ley de Charles. Wikipedia
Gif ley de Charles. Wikipedia
Matemáticamente esta ley la podemos expresar:
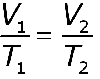
Dónde el volumen se expresa en litros y la temperatura en Kelvin.
Si queremos ampliar nuestros conocimientos sobre esta ley podemos visitar los siguientes enlaces:
Ley de Gay-Lussac
El químico francés Joseph-Louis Gay-Lussac estudió experimentalmente el comportamiento de los gases manteniendo constante el volumen, llegando a la conclusión que al aumentar la temperatura aumentaba la presión
La ley de Gay-Lussac establece que cuando un gas sufre una transformación a volumen constante, la temperatura del gas es directamente proporcional a la presión.
La siguiente imagen nos muestra como al aumentar la temperatura, las partículas se mueven a más velocidad, aumentando el número de choques y por tanto la presión:
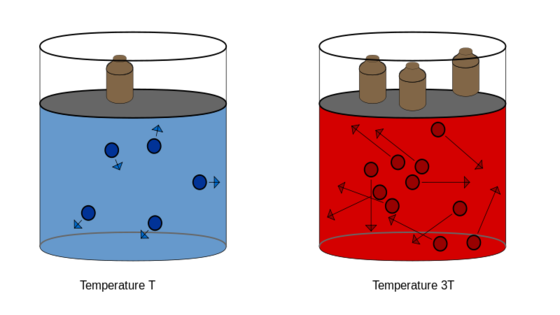
Ley de Gay-Lussac. Wikimedia Commons
Matemáticamente esta ley se expresa:
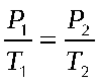
Dónde la presión se expresa en atmósfera y la temperatura en Kelvin.
Si queremos ampliar nuestros conocimientos sobre esta ley podemos visitar los siguientes enlaces: