¿Qué son los isótopos?
Seguro que has oído hablar de los isótopos en más de una ocasión, en las noticias, televisión, radio, o en las películas. Es frecuente, por ejemplo oir hablar del isótopo del Carbono 14, que es un isótopo radiactivo del carbono y se utiliza, por ejemplo para datar documentos, fósil, huesos, etc...
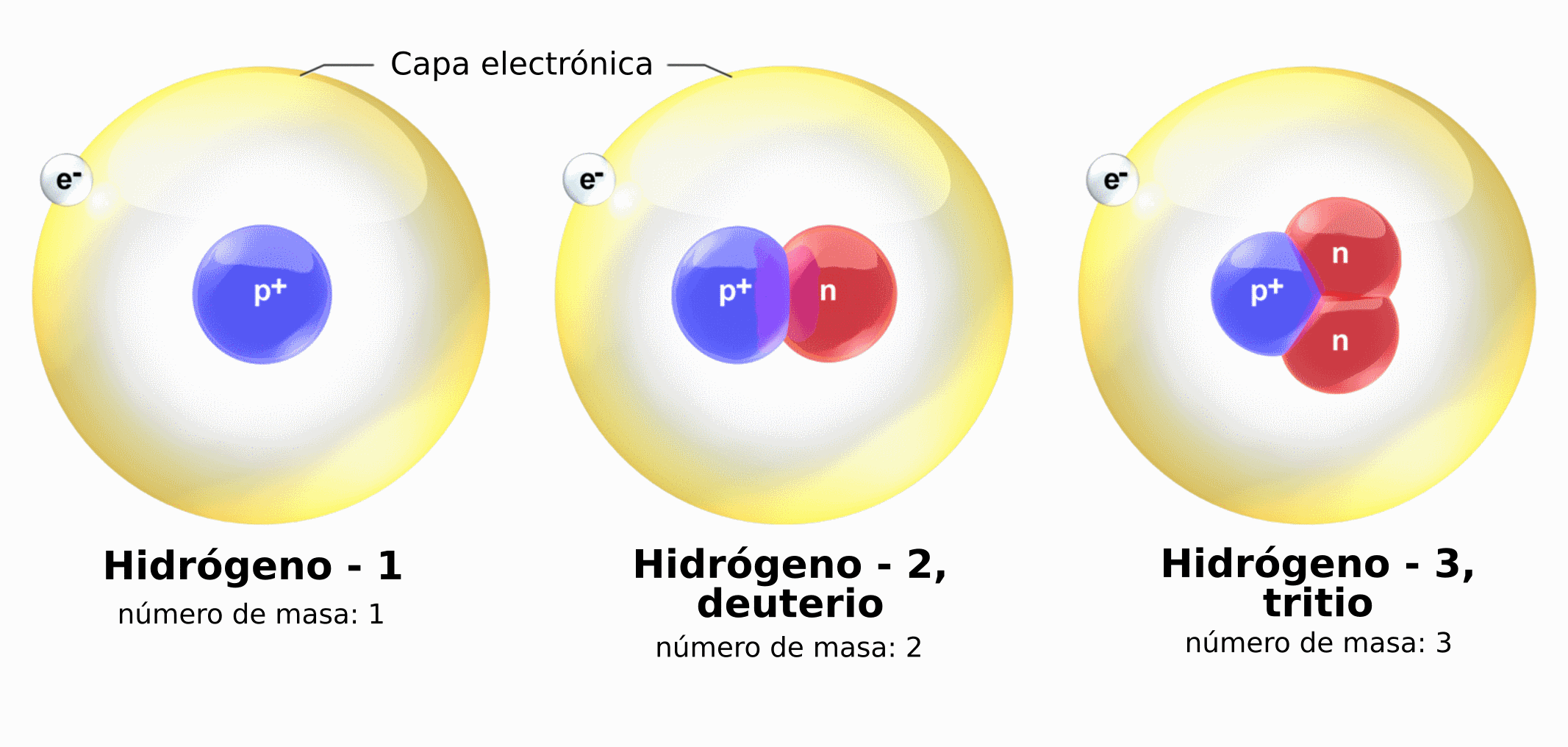
Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones. Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A).
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones. Por ejemplo, el hidrógeno, como se ve en la imagen, tiene tres isótopos.